2. Eigenschaften der Aggregatzustände#
Die Temperatur bestimmt den Aggregatzustand. Ist die Temperatur so klein, dass die mittlere kinetische Energie der Moleküle nicht ausreicht, um feste Gitterstrukturen aufzubrechen, bilden sich Festkörper. Hat die Temperatur einen bestimmten Wert überschritten, werden diese festen Strukturen aufgebrochen und das Material wird flüssig beziehungsweise gasförmig. Der dafür notwendige Wert der Temperatur hängt von der Stärke der Bindung der Gitterstruktur im Festkörper ab (siehe Abbildung 2.34).
Fig. 2.34 Temperaturabhängige Häufigkeit der Aggregatzustände der Elemente Von RokerHRO#
2.1. Festkörper#
Festkörper sind Stoffe, deren Moleküle/Atome in einer festen Stuktur eingebunden sind. Bewegungen der Teilchen finden durch Schwingungen um ihre Ruhelage statt oder in eingeschränkter Form durch Diffusion.
Der Zusammenhalt eines Festkörpers beruht auf einer attraktiven(anziehenden) Wechselwirkung zwischen den Atomen bzw. Molekülen auf großen Distanzen und einer repulsiven auf kurzen. Den energetisch günstigsten Abstand nennt man Gleichgewichtsabstand (siehe Abbildung 2.35). Bewegt sich ein Molekül/Atom von seiner Gleichgewichtslage weg, so überwiegen je nach Richtung anziehende oder abstoßende Kräfte, die das Molekül/Atom wieder in Richtung Gleichgewichtslage bewegen.
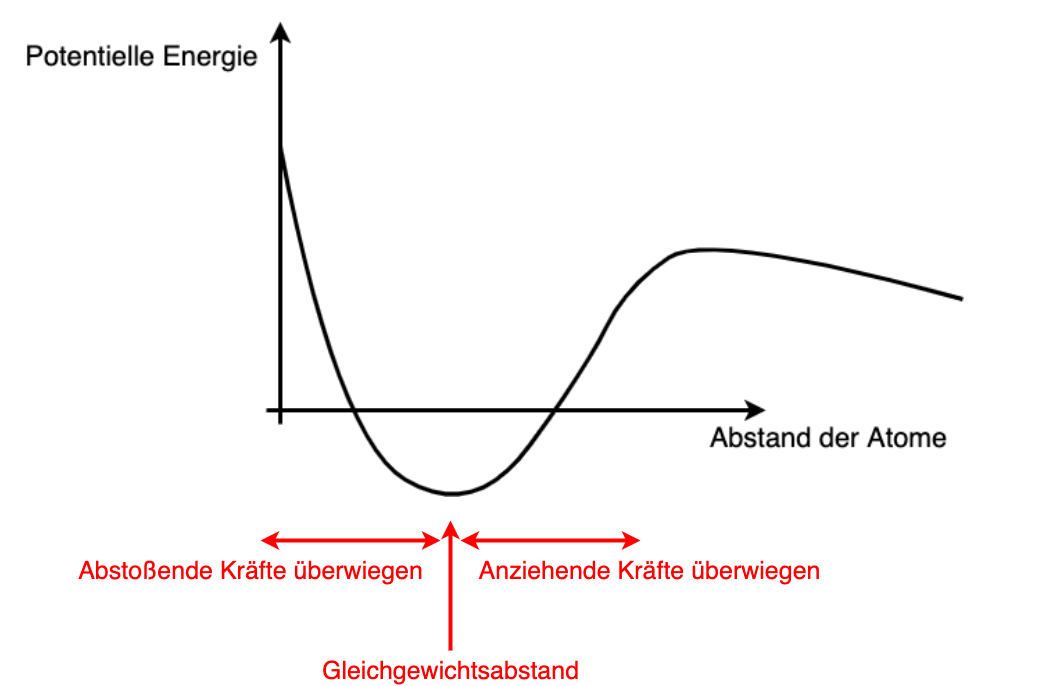
Fig. 2.35 Potentielle Energie im Festkörper#
Die genaue Struktur eines Festkörpers kann sehr komplex werden. Im Folgenden werden nur die wichtigsten Bindungen beschrieben, die zur Bildung einer Festkörperstruktor führen.
Da die auftretenden Bindungen allein von der Anzahl der Elektronen in der äußeren Schale abhängen, können die Strukturen mit Hilfe des Periodensystems der Elemente ermittelt werden.
2.1.1. Ionenbindung#
Diese Art der Bindung tritt auf, wenn der Festkörper aus unterschiedlichen Elementen aufgebaut ist, welche eine unterschiedliche Elektronegativität besitzen. Dabei gibt das eine Element dem anderen ein Elektron ab, also das eine zum Anion und das andere zum Kation wird. Die unterschiedlichen Ladungen bewirken eine elektrostatische Anziehung. Salze sind ein typischer Vertreter dieser Bindungsart.
In den folgenden Abbildungen (Abbildung 2.36, Abbildung 2.37,Abbildung 2.38) wird die Ionenbindung anhand des Moleküls Natriumchlorid (NaCl) dargestellt.
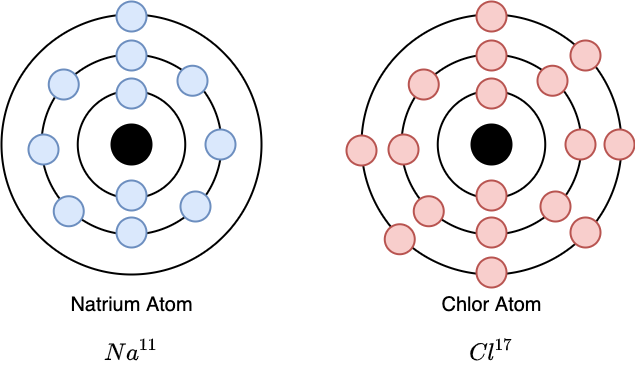
Fig. 2.36 Natrium-Atome haben ein Elektron, welches sich allein auf einer äußeren “Umlaufbahn” (Schale) befindet. Chlorid-Atome haben auf dieser äußeren Schale gerade noch Platz für ein weiteres Elektron. Die Entstehung dieser Schalen wird in ihrer einfachsten Form durch das Bohr’sche Atommodell beschrieben.#
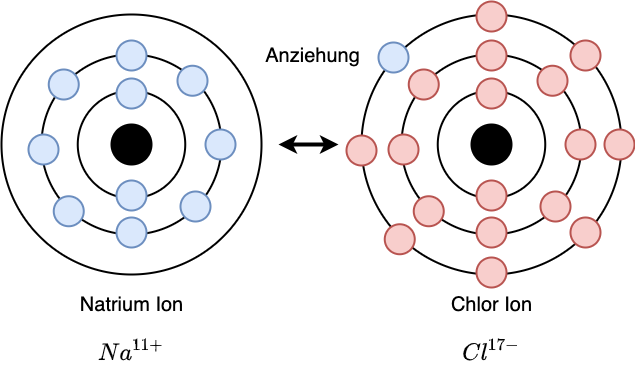
Fig. 2.37 Das äußere Elektron des Natrium-Atoms nimmt den freien Platz in der äußeren Schale des Chlor-Atoms ein, da dieser Zustand insgesamt energetisch günstiger ist. Damit ist nun das Natrium-Atom positiv, das Chlor-Atom negativ geladen#
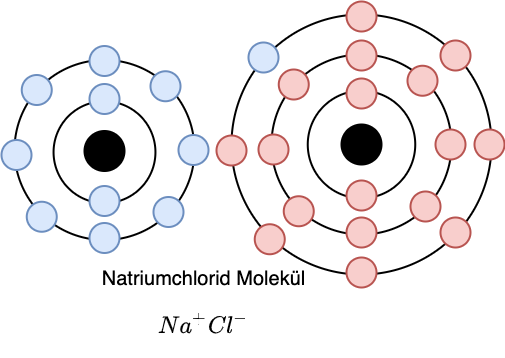
Fig. 2.38 Durch die unterschiedliche Ladung werden die beiden Atome elektromagnetisch angezogen und bilden ein \(Na^+Cl^-\) Molekül.#
2.1.2. Kovalente Bindung#
Anschaulich lässt sich die kovalente Bindung wie folgt beschreiben: diese Art der Bindung tritt bei Atomen auf, die beide in der äußersten Schale freie Plätze haben. Hier ist es dann energetisch günstiger, sich die äußeren Elektronen zu “teilen” und somit scheinbar volle äußere Schalen zu erhalten. Insgesamt gesehen stellt sich auf diese Weise wieder ein energetisch günstigerer Zustand ein.
Bekanntes Beispiel dieses Bindungstyps ist das \(H_2\)-Molekül (Abbildung 2.39) und das Wassermolekül \(H_2O\) (Abbildung 2.40).
Fig. 2.39 Kovalente Bindung beim Wasserstoffmolekül \(H_2\).#
Fig. 2.40 Kovalente Bindung beim Wassermolekül \(H_2O\).#
2.1.3. Metalle#
Eine Metallbindung enteht, wenn alle Atome, die sich verbinden wollen, einen Überschuss an Elektronen in der äußeren Schale haben. Die Metallbindung ist ein Extremfall der Atombindung. Auch diese Bindung ist in einer Absenkung der Gesamtebenergie bedingt. Die Überlappung der Wechselwirkung zwischen den Atomen ist hierbei zo groß, dass nicht nur Wechselwirkungen zwischen den nächsten Nachbarn, sondern auch darüber hinaus signifikant sind. Eine anschauliche Vorstellung ist, dass die Ionenrümpfe der Atome in einen Elektronensee eingebettet sind (siehe Abbildung 2.41). Diese Art der Bindung ist in der elektrotechnik besonders wichtig, hieraus resultiert beispielsweise auch das Bändermodell, mit dem sich die elektrischen Eigenschaften (Leiter, Isolator, Halbleiter) von Materialien erklären lassen.
Fig. 2.41 Metallbindung bei Natrium Atomen.#
2.1.4. Van-der-Waals Bindung#
Die Van-der-Waals-Wechselwirkung ist die schwächste und auch die komplizierteste der hier beschriebenen Wechselwirkungen. Van-der-Waals-Wechselwirkungen treten grundsätzlich immer auf, sind allerdings so schwach, dass sie sich nur bei Abwesenheit anderer Bindungsarten so bemerkbar machen, dass von regelrechten Van-der-Waals-Bindungen gesprochen werden kann.
Die Van-der-Waals-Wechselwirkung wird durch lokal induzierte Dipolmomente in der Elektronendichte verursacht. Sie nimmt mit dem reziproken Abstand in 7. Potenz ab, \(\Rightarrow F_{Van-der-Waals} \propto \frac{1}{r^7}\)
Edelgaskristalle haben vollständig gefüllte Schalen werden daher nur durch Van-der-Waals-Wechselwirkungen zusammengehalten.
2.2. Flüssigkeiten#
Bei Flüssigkeiten ist die Temperatur so groß, dass die kinetische Energie der Moleküle/Atome die größer ist, als die Energie mit der die Moleküle/Atome in ihrer bevorzugten Gitterstruktur gebunden sind. Die Moleküle/Atome sind daher beweglich. Dennoch ist der Abstand der Moleküle/Atome gering und es findet weiter eine e;elektromagnetische Wechselwirkung statt, dies bedeutet elektromagnetische Kräfte bleiben weiterhin wichtig.
Von außen betrachtet sind Flüssigkeiten Stoffe, die
einer Formänderung so gut wie keinen,
einer Volumenänderung hingegen einen recht großen Widerstand entgegensetzt
\(\Longrightarrow\) Flüssigkeiten passen sich der Form an, sind jedoch inkompressibel
2.3. Gase#
In Gasen ist die mittlere kinetische Energie der Teilchen so groß, dass elektromagnetische oder chemische Wechselwirkungen ein vernachlässigbar kleine Rolle spielen. Die Wechselwirkung findet hauptsächlich durch Stoßprozesse statt. Dies bedeutet aber auch, dass der Stoff, aus dem das Gas besteht, für die Welchselwirkung eine vernachlässigbar kleine Rolle darstellt. Derartige Gase bezeichnet man als ideale Gase, sie können unabhängig vom ihrer atomaren Struktur durch dieselben Gleichungen beschrieben werden.
Ein Gas oder gasförmiger Stoff verteilt sich schnell in einem Raum.
Von außen betrachtet sind Gase Stoffe, die:
hochgradig komprimierbar sind
In einem geschlossenen Raum führt das Stoßen der Atome/Moleküle gegen die Wände einen Gasdruck erzeugen
\(\Longrightarrow\) Je stärker ein Gas komprimiert wird, desto größer ist der Druck
2.4. Plasma#
Oft wird noch das Plasma als weiterer Aggregatzustand genannt. Dies ist jedoch nur eingeschränkt ein Aggregatzustand. Die Bewegungsenergie ist beim Plasma so hoch, dass die Atome ionisiert sind und Elektronen und Atomkerne sich getrennt voneinander bewegen. Damit sind die Atome aber nicht mehr intakt, so dass das Plasma über die klassische Betrachtungsweise der Aggregatzustände hinausgeht.
